阿糖胞苷
 | |
| 临床资料 | |
|---|---|
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a682222 |
| 怀孕分级 |
|
| 给药途径 | 注射(静脉注射、鞘内注射或皮下注射) |
| ATC码 | |
| 法律规范状态 | |
| 法律规范 |
|
| 药物动力学数据 | |
| 生物利用度 | 20% (如经口服的结果,但并非表示是一种可行的治疗方法) |
| 血浆蛋白结合率 | 13% |
| 药物代谢 | 肝脏 |
| 生物半衰期 | 两相分别为10分钟与1-3小时 |
| 排泄途径 | 肾脏 |
| 识别信息 | |
| |
| CAS号 | 147-94-4 |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.005.188 |
| 化学信息 | |
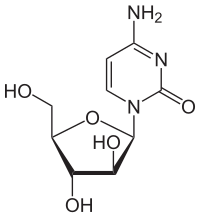
| 化学式 | C9H13N3O5 |
| 摩尔质量 | 243.22 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
阿糖胞苷(cytosine arabinoside[1][2],ara-C;INN:cytarabine[3][4]),是胞嘧啶与阿糖形成的糖苷化合物[5],属于一种嘧啶类抗代谢药。作为化学治疗药物,一般用于治疗急性骨髓性白血病(AML)、急性淋巴性白血病(ALL)、慢性骨髓细胞性白血病(CML)和非霍奇金氏淋巴瘤[6][7]。
给药方式有静脉注射、皮下注射或鞘内注射[6]。此药物还有脂质体形式制剂,初步证据显示其在脑脊膜淋巴瘤的治疗中可能有较好的疗效[6]。
用药后常见的副作用有骨髓抑制、呕吐、腹泻、肝脏问题、皮疹、口腔溃疡及出血等。其他较严重的副作用有意识丧失、肺部疾病及过敏反应。个体于怀孕期间使用,可能会对胎儿造成伤害[6]。阿糖胞苷属于抗代谢物以及核苷类似物药物[8]。此药物以竞争性抑制DNA聚合酶的运作,可有效抑制癌细胞DNA生物合成与分裂而发挥作用[6]。
阿糖胞苷于1960年取得专利,并在1969年获准用于医疗用途[9]。此药物已列入世界卫生组织基本药物标准清单之中[10]。
阿糖胞苷简称 ara-C,其来源于英文全称 "ara"binofuranosyl "c"ytidine 两词的开头[11]。
医疗用途
[编辑]阿糖胞苷主要应用于急性骨髓性白血病、急性淋巴性白血病以及淋巴瘤的治疗,[12]它是针对前述疾病的核心诱导性化疗药物。阿糖胞苷亦具备抗病毒活性,曾被用于治疗全身性疱疹病毒科感染。然而在此应用情境下,阿糖胞苷的选择性较差,容易对其他非目标细胞产生显著的副作用(如引发骨髓抑制等)。因此并不适合当作人类的抗病毒药物。[13]
阿糖胞苷亦应用于神经系统研究,以调控培养环境中神经胶质细胞的增生。神经胶质细胞数量对神经元有显著影响[14]。近期研究显示,阿糖胞苷可于NSC-34运动神经元相似细胞株中,促使稳健且持续的神经元分化。在NSC-34细胞的神经突起始及机械性分离后的再生过程中,阿糖胞苷扮演着许可、非必要,且多数情况下不可逆的角色[15]。
阿糖胞苷具有抗病毒作用,并被用来治疗各种疱疹病毒的感染。但是由于阿糖胞苷的抗病毒选择性较差且能够引起骨髓抑制及其他严重的不良反应,它主要仍被用于恶性血液病。
阿糖胞苷经静脉注射进入人体后,会迅速被去胺化,成不活化状态,而迅速从人体清除,所以需要在5到7天内持续性的输注才有效果。
副作用
[编辑]阿糖胞苷的其中一种独特副作用是大剂量时其对于小脑的毒性。
其他不良反应有:贫血、血小板减少症、白细胞减少症、胃炎、结膜炎、皮肤炎、发热和痛风。
曾有高剂量或高频率阿糖胞苷给药引起脊髓炎的报道,不过十分罕见[16]。
药理学
[编辑]作用机理
[编辑]阿糖胞苷能够干扰DNA的合成,同时也是一种抗代谢物。它能够在人体内被脱氧胞苷激酶迅速转化为三磷酸阿糖胞苷[17],其被认为是主要产生细胞毒性代谢物,会在细胞周期S期中,三磷酸阿糖胞苷会竞争性的去抑制DNA聚合酶 (包括DNA polymerase-α和DNA polymerase-β,前者的抑制效果影响到DNA的合成,后者则是影响到DNA的修复)。此外,三磷酸阿糖胞苷还会嵌合进RNA和DNA,干扰到长链的延长和新合成DNA的连接,其皆可达到细胞毒性的效果。所以,需要DNA的复制来进行有丝分裂的快速分裂的细胞(如癌细胞和骨髓细胞)受到的影响最大。阿糖胞苷还能够影响DNA聚合酶、RNA聚合酶及核苷酸还原酶这些DNA合成中的重要酶类的工作。[18]
当用作抗病毒药物时,阿糖胞苷的机理是阻止脱氧胞苷的作用。[19]
在人体内阿糖胞苷会迅速脱氨基化形成无药效的尿嘧啶衍生物,因此该药物通常以持续静脉注射的方式给药。
这种药物的化学结构是胞嘧啶与阿拉伯糖结合成的核苷,因此得名“阿糖胞苷”。正常情况下,胞嘧啶与另一种糖类(脱氧核糖)结合,形成DNA的成分之一脱氧胞苷。然而有些多孔动物门生物能用阿拉伯糖与胞嘧啶结合成另一种化合物(不是DNA的成分),人们在这些生物体中发现了此化合物,即阿糖胞苷。阿糖胞苷与脱氧胞苷十分类似以至于能够代替后者并入人类DNA,然而结构上的不同又使得DNA无法复制,进而杀死受影响的细胞。用药时,阿糖胞苷以这种作用机理被杀死癌细胞。它是第一种以改变核苷本身而作用的化疗药物——其他更早期的类似药物(如5-氟尿嘧啶)改变的是碱基。[20]
药代动力学
[编辑]口服时,仅有少于20%的阿糖胞苷被消化系统吸收,效果很差。口服后会因首关效应,迅速被肝脏的胞嘧啶脱氨酶代谢为无活性的尿嘧啶阿糖胞苷(氟达拉滨)。[17]而皮下或肌肉注射时,经过氚标记的阿糖胞苷在给药20到60分钟之间产生血浆放射性峰浓度远比静脉注射的低。至于连续静脉注射则能够产生的相对恒定的血浆药物水平。
静脉注射的阿糖胞苷在人体内表现为两相代谢:初级代谢半衰期约10分钟,在这段时间里,大部分的阿糖胞苷在肝脏中转化为为无药效的代谢物尿嘧啶阿糖胞苷;二级代谢(即尿嘧啶阿糖胞苷的代谢)半衰期较长,约为1至3个小时。代谢也发生在肾脏,胃肠道粘膜,粒细胞和其他组织。
任何给药方式的阿糖胞苷主要通过肾脏排泄——24小时内70%至80%的给药剂量会出现在尿液中;其中约90%为代谢产物,10%为原药。[21]
合成路径
[编辑]阿糖胞苷可由D-阿拉伯糖为起始,与氰胺形成2-氨基-D-阿糖𫫇唑啉,再与2-氯-丙烯腈合环,脱氯化氢制得。[17]
历史
[编辑]自加勒比海海绵隐秘海绵(Cryptotheca crypta,现归类为Tectitethya crypta中分离出含有阿拉伯糖的核苷酸,且发现这些化合物能作为DNA合成链的终止剂,而促使人们开始研究这些新颖的核苷酸,将其视为潜在的抗癌药物。[22]阿糖胞苷最早在1959年由加州大学伯克利分校的Richard Walwick、Walden Roberts和Charles Dekker合成。[23]
美国食品药品监督管理局(FDA)在1969年6月批准阿糖胞苷进入市场。它最初由Upjohn公司以Cytosar-U的商品名出售。[24]
商品名
[编辑]参考资料
[编辑]- ^ 李莉霞,唐跃年.阿糖胞苷抗白血病药理作用及耐药机制研究进展[J].中国药房, 2006, 17(19):2.DOI:10.3969/j.issn.1001-0408.2006.19.028.
- ^ 叶启东.阿糖胞苷治疗白血病基础和临床研究进展[J].临床儿科杂志, 2003, 21(9):586-587.DOI:10.3969/j.issn.1000-3606.2003.09.029.
- ^ J. Elks. The Dictionary of Drugs: Chemical Data, Structures and Bibliographies. Springer. 2014: 343. ISBN 9781475720853.
- ^ John Buckingham. Dictionary of Natural Products. CRC Press. 1993: 1265. ISBN 9780412466205.
- ^ 阿糖胞苷. 术语在线. 全国科学技术名词审定委员会. (简体中文)
- ^ 6.0 6.1 6.2 6.3 6.4 Cytarabine. The American Society of Health-System Pharmacists. [2016-12-08]. (原始内容存档于2016-06-11).
- ^ Wang WS, Tzeng CH, Chiou TJ; et al. High-dose cytarabine and mitoxantrone as salvage therapy for refractory non-Hodgkin's lymphoma. Jpn. J. Clin. Oncol. June 1997, 27 (3): 154–7 [2011-11-26]. PMID 9255269. doi:10.1093/jjco/27.3.154. (原始内容存档于2019-07-13).
- ^ British national formulary: BNF 69 69. British Medical Association. 2015: 589. ISBN 9780857111562.
- ^ Fischer J, Ganellin CR. Analogue-based Drug Discovery. John Wiley & Sons. 2006: 511. ISBN 9783527607495. (原始内容存档于2016-12-20) (英语).
- ^ World Health Organization. World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. 2019. hdl:10665/325771
 . WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Ogbomo H, Michaelis M, Klassert D, Doerr HW, Cinatl J. Resistance to cytarabine induces the up-regulation of NKG2D ligands and enhances natural killer cell lysis of leukemic cells. Neoplasia. December 2008, 10 (12): 1402–10 [2011-11-26]. PMC 2586691
 . PMID 19048119. (原始内容存档于2012-02-26).
. PMID 19048119. (原始内容存档于2012-02-26).
- ^ Pigneux A, Perreau V, Jourdan E, Vey N, Dastugue N, Huguet F, Sotto JJ, Salmi LR, Ifrah N, Reiffers J. Adding lomustine to idarubicin and cytarabine for induction chemotherapy in older patients with acute myeloid leukemia: the BGMT 95 trial results. Haematologica. October 2007, 92 (10): 1327–1334. PMID 18024370. doi:10.3324/haematol.11068
 .
.
- ^ Lauter CB, Bailey EJ, Lerner AM. Assessment of cytosine arabinoside as an antiviral agent in humans. Antimicrobial Agents and Chemotherapy. November 1974, 6 (5): 598–602. PMC 444699
 . PMID 15825312. doi:10.1128/aac.6.5.598.
. PMID 15825312. doi:10.1128/aac.6.5.598.
- ^ Schwieger, Jana; Esser, Karl-Heinz. Establishment of a long-term spiral ganglion neuron culture with reduced glial cell number: Effects of AraC on cell composition and neurons. Journal of Neuroscience Methods. 2016-08-01, 268: 106–116 [2025-03-07]. doi:10.1016/j.jneumeth.2016.05.001.
- ^ Vitale G, Amadio S, Liguori F, Volonté C. Empowering the NSC-34 cell line as a motor neuron model: cytosine arabinoside's action. Neural Regeneration Research. September 2024. PMID 39314144. doi:10.4103/NRR.NRR-D-24-00034
 .
.
- ^ Watterson J, Toogood I, Nieder M; et al. Excessive spinal cord toxicity from intensive central nervous system-directed therapies. Cancer. December 1994, 74 (11): 3034–41. PMID 7954266. doi:10.1002/1097-0142(19941201)74:11<3034::AID-CNCR2820741122>3.0.CO;2-O.
- ^ 17.0 17.1 17.2 郑虎. 药物化学. 北京: 人民卫生出版社. 2007: 238–239. ISBN 978-7-117-09023-0.
- ^ Perry, Michael J. The Chemotherapy source book. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. 2008: 80. ISBN 0-7817-7328-8.
- ^ Lemke, Thomas L.; Williams, David H.; Foye, William O. Foye's principles of medicinal chemistry. Hagerstwon, MD: Lippincott Williams & Wilkins. 2002: 963. ISBN 0-683-30737-1.
- ^ Feist, Patty. A Tale from the Sea to Ara C. April 2005 [2011-11-26]. (原始内容存档于2007-03-06).
- ^ CYTARABINE (PDF). medsafe.govt.nz. Medsafe. 2005-05-04 [2011-11-29]. (原始内容存档 (PDF)于2021-02-25).
- ^ Schwartsmann G, Brondani da Rocha A, Berlinck RG, Jimeno J. Marine organisms as a source of new anticancer agents. The Lancet. Oncology. April 2001, 2 (4): 221–225. PMID 11905767. doi:10.1016/s1470-2045(00)00292-8.
- ^ Sneader, Walter. Drug discovery: a history. New York: Wiley. 2005: 258. ISBN 0-471-89979-8.
- ^ Cytarabine. bionity.com. [2025-03-07].
外部链接
[编辑]- MedlinePlus (页面存档备份,存于互联网档案馆)上阿糖胞苷的介绍
- ADAP drugs上阿糖胞苷的介绍
- BC Cancer network上阿糖胞苷的介绍
- Chembank上阿糖胞苷的介绍
- Sea to Ara C (页面存档备份,存于互联网档案馆):阿糖胞苷的历史
